Kondensacja Claisena – reakcja chemiczna, w której estry ulegają acylowaniu związkami karbonylowymi. Reakcja pomiędzy dwiema cząsteczkami estru prowadzi do utworzenia β-ketoestru, natomiast w reakcji estru z innym związkiem karbonylowym powstają β-diketony bądź β-oksoaldehydy.
Nazwa pochodzi od niemieckiego chemika Ludwiga Claisena (1851–1930), który jako pierwszy opisał reakcje tego typu w roku 1881[1][2].
Wymagania
[edytuj | edytuj kod]Przynajmniej jeden z substratów reakcji musi podlegać enolizacji oraz posiadać dwa protony przy atomie węgla w położeniu α do grupy karbonylowej (tzw. α-protony). Odłączenie pierwszego protonu prowadzi do powstania karboanionu stabilizowanego rezonansem, a odłączenie drugiego protonu, w przebiegu nieodwracalnej reakcji, pozwala na przesunięcie równowagi reakcji w kierunku tworzenia się stabilnego jonu enolanowego.
Stosowana zasada nie może ulegać substytucji nukleofilowej lub addycji do karbonylowego atomu węgla. Do często stosowanych w tej reakcji zasad należą alkoholany np. etanolan sodu. By zapobiec wystąpieniu niekorzystnej transestryfikacji, wybiera się alkoholan tożsamy z odchodzącą grupą alkoksylową. Stosuje się równoważną molowo ilość alkoholanu, a nie ilość katalityczną, gdyż utworzenie anionu enolanowego zachodzi tylko, gdy alkoholan zostanie podany w ilości gwarantującej usunięcie obu α-protonów. W mieszanej kondensacji Claisena jako zasady można użyć diizopropyloamidku litu (LDA). Podczas kondensacji estrów o rozgałęzionym łańcuchu węglowym niezbędne jest zastosowanie silniejszej zasady, np. trifenylometylosodu lub wodorku sodu.
Grupa alkoksylowa estru poddawanego kondensacji powinna być grupą łatwo opuszczającą o niewielkiej masie cząsteczkowej. Najlepiej opuszczającą powstały addukt grupą jest grupa metoksylowa lub etoksylowa.
Przykładem kondensacji Claisena jest synteza acetylooctanu etylu (2) z octanu etylu (1); produktem ubocznym jest etanol (3):
Mechanizm reakcji
[edytuj | edytuj kod]W pierwszym etapie reakcji zasada usuwa α-proton tworząc karboanion, którego trwałość wynika z efektu rezonansowego. Następnie zachodzi nukleofilowy atak karboanionu na grupę karbonylową drugiego reagenta. W powstałym tetraedrycznym addukcie zachodzi eliminacja grupy alkoksylowej, a użyty w pierwszym etapie reakcji alkoholan ulega regeneracji. W kolejnym etapie alkoholan usuwa drugi α-proton i powstaje mezomeryczny anion enolanowy. Jest to jedyny nieodwracalny etap w kondensacji Claisena. Powstały anion enolanowy jest słabą zasadą, która nie jest w stanie deprotonować obecnego w wodzie alkoholu oraz nieprzereagowanego estru. Z tego samego powodu jon enolanowy nie może reagować z kolejną cząstkę estru. Nieodwracalność tego etapu korzystnie przesuwa równowagę reakcji w kierunku tworzenia się produktu, zwiększając wydajność prowadzonej reakcji. W ostatnim etapie dodaje się kwasu (np. siarkowego lub fosforowego), by zneutralizować jony enolanowe oraz panujące środowisko zasadowe, i powstaje końcowy β-ketoester.

|
| animacja |
Mieszana kondensacja Claisena
[edytuj | edytuj kod]Mieszaną kondensację Claisena można prowadzić pomiędzy dwoma różnymi estrami lub między estrem a innym związkiem karbonylowym (ketonem bądź aldehydem).
Podczas kondensacji dwóch różnych estrów otrzymuje się mieszane produkty β-ketoestrowe. Wydajność reakcji jest wyższa, jeśli jeden reagujący ester nie ma dwóch α-protonów (np. benzoesan etylu i mrówczan etylu). W takim przypadku powstają tylko dwa produkty reakcji, a nie aż cztery różne β-ketoestry.
Prowadząc kondensację między estrem a ketonem, to właśnie ten drugi jest donorem nukleofilowym (jeśli tylko ma dwa α-protony). Dzieje się tak dlatego, że estry charakteryzują się słabszymi właściwościami kwasowymi, zatem trudniej oddają protony. Proces odłączenia protonów od estru wymaga większej energii, więc preferowana jest addycja ketonu do estru. Efektem końcowym reakcji jest β-diketon lub β-oksoaldehyd.
Przykładem mieszanej kondensacji Claisena jest synteza symetrycznego diketonu, 1,3-difenylopropano-1,3-dionu (3) z benzoesanu etylu (1) i acetofenonu (2); produktem ubocznym jest etanol (4):
Cyklizacja Dieckmanna
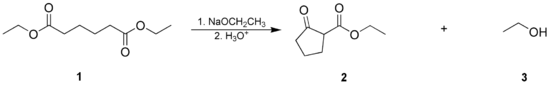
[edytuj | edytuj kod]Wewnątrzcząsteczkowa kondensacja Claisena znana jest jako kondensacja Dieckmanna (lub cyklizacja Dieckmanna). Zachodzi ona np. dla związków zawierających dwie grupy estrowe. Przykładową reakcją tego typu jest cyklizacja dietylowego estru kwasu adypinowego (1) do 2-oksocyklopentanokarboksylanu etylu (2); produktem ubocznym jest etanol (3):
Cyklizacja Dieckmanna zachodzi wydajnie, jeśli produktem reakcji są pierścienie 5- i 6-członowe[3].
Przypisy
[edytuj | edytuj kod]- ↑ Claisen, L.; Claparede, A.. Condensationen von Ketonen mit Aldehyden. „Berichte der Deutschen Chemischen Gesellschaft”. 14 (2), s. 2460–2468, 1881. DOI: 10.1002/cber.188101402192. (niem.).
- ↑ Anschütz, R.. Ludwig Claisen. Ein Gedenkblatt. „Berichte der Deutschen Chemischen Gesellschaft”. 69 (7), s. A97–A170, 1936. DOI: 10.1002/cber.19360690746. (niem.).
- ↑ Dieckmann Condensation. Organic Chemistry Portal. (ang.).
Bibliografia
[edytuj | edytuj kod]- John McMurry: Chemia organiczna. Wyd. 3. Warszawa: PWN, 2005, s. 914-917. ISBN 83-01-14406-8.
- Przemysław Mastalerz: Podręcznik Chemii Organicznej. Wrocław: Wydawnictwo Chemiczne, 1998, s. 423-425.