Spis treści
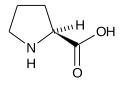
Prolina
| |||||||||||||||||||||||
| |||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||
| Wzór sumaryczny |
C5H9NO2 | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
115,13 g/mol | ||||||||||||||||||||||
| Wygląd |
krystaliczne ciało stałe | ||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||
| DrugBank | |||||||||||||||||||||||
| |||||||||||||||||||||||
| |||||||||||||||||||||||
| |||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||
Prolina (nazwa skrótowa Pro lub P) – organiczny związek chemiczny z grupy α-aminokwasów, zawierającym w swej strukturze pięcioczłonowy pierścień pirolidynowy. Enancjomer L proliny jest aminokwasem naturalnym, endogennym i glukogennym. Ze względu na obecność dodatkowego wiązania węgiel–azot jest czasem nazywana (chociaż niepoprawnie) iminokwasem (z punktu widzenia chemii nie jest iminą, lecz aminą drugorzędową). Punkt izoelektryczny, pI = 6,30[1].
Prolina ma słodki smak (jak większość aminokwasów).
Prolina jest składnikiem wielu białek, wpływającym w znacznym stopniu na ich strukturę trzeciorzędową. Struktura helisy alfa jest niemal pozbawiona proliny. Aminokwas ten obok swojej pochodnej – hydroksyproliny jest głównym składnikiem struktury helisy kolagenu. Przekształcenie proliny w hydroksyprolinę jest katalizowane przez hydroksylazę prolinową w obecności koenzymu – witaminy C. Zaburzenia tego procesu wskutek niedoboru witaminy C mogą prowadzić do szkorbutu. W mRNA prolina kodowana jest przez kodony CCU, CCC, CCA oraz CCG.
Katabolizm
[edytuj | edytuj kod]Katabolizm proliny zachodzi w mitochondriach. Nie ulega ona transaminacji i musi być najpierw przekształcona do glutaminianu[2].
Początkowo prolina utleniana jest do Δ1-pyrolino-5-karboksylanu, reakcja ta katalizowana przez dehydrogenazę prolinową, której koenzymem jest NAD+. Przekształca się on w γ-semialdehyd L-glutaminowy[2].
γ-semialdehyd L-glutaminowy ulega utlenieniu do L-glutaminianu przy udziale dehydrogenazy Δ1-pyrolino-5-karboksylowej (zwanej również dehydrogenazą semialdehydo-L-glutaminianowej), której koenzymem jest NAD+[2].
Zaburzenia metaboliczne związane z katabolizmem proliny[2]
[edytuj | edytuj kod]- Hiperprolinemia typu I - defekt metaboliczny dehydrogenazy prolinowej
- Hiperprolinemia typu II - defekt metaboliczny dehydrogenazy Δ1-pyrolino-5-karboksylowej
Przypisy
[edytuj | edytuj kod]- ↑ a b c CRC Handbook of Chemistry and Physics. Wyd. 83. Boca Raton: CRC Press, 2003, s. 7-1.
- ↑ a b c d Katabolizm szkieletów węglowych aminokwasów, [w:] Victor W. Rodwell, David A. Bender, Kathleen M. Botham, Peter J. Kennelly, P. Anthony Weil, Biochemia Harpera Ilustrowana, wyd. VII, PZWL Wydawnictwo Lekarskie, 2018, s. 379, 381, ISBN 978-83-200-5410-1 (pol.).