
Antybiotyki (z gr. ἀντί, anti „przeciw” i βίος, bios „życie”) – naturalne wtórne produkty metabolizmu mikroorganizmów, które działając wybiórczo w niskich stężeniach wpływają na struktury komórkowe lub procesy metaboliczne innych mikroorganizmów, hamując ich wzrost i podziały. Antybiotyki są przedmiotem badań auksanografii, stosuje się je jako najważniejsze środki w leczeniu wszelkiego rodzaju zakażeń bakteryjnych. Bywają także używane profilaktycznie przed zabiegami chirurgicznymi, w zapobieganiu zakażeniom bakteryjnym w przypadku osłabienia odporności, na przykład neutropenii, a także w profilaktyce bakteryjnego zapalenia wsierdzia[1][2][3][4].
Pochodzenie słowa
[edytuj | edytuj kod]Nazwa odwołuje się do zabójczego dla żywych bakterii działania antybiotyków. Naukowcy wiedzieli już w XIX w., że niektóre organizmy przeciwdziałają rozwojowi bakterii. Zjawisko to nazwano antybiozą a termin ten wprowadził francuski bakteriolog Jean Paul Vuillemin. Antybiozę po raz pierwszy opisali w 1877 Louis Pasteur i Robert Koch, gdy zaobserwowali, że unosząca się w powietrzu pałeczka może hamować wzrost Bacillus anthracis. W 1947 leki, które są produkowane przez mikroorganizmy i zabijają lub hamują rozwój bakterii, zostały przemianowane na antybiotyki przez Selmana Waksmana, amerykańskiego mikrobiologa[5].
Obecnie termin „antybiotyk” jest stosowany do każdego leku, który zabija bakterie lub hamuje ich wzrost, niezależnie od tego, czy lek ten jest wytwarzany przez mikroorganizm, czy nie[6].
Historia
[edytuj | edytuj kod]Odkrycie pierwszego antybiotyku (penicyliny) zostało dokonane w 1928 roku przez Alexandra Fleminga[7], który zauważył, że przypadkowe zanieczyszczenie podłoża pleśnią Penicillium chrysogenum powstrzymuje wzrost kultur bakterii z rodzaju Staphylococcus[8].
Oprócz pleśni zdolnością wytwarzania antybiotyków wyróżniają się promieniowce i niektóre bakterie[9].
Wkrótce po odkryciu penicyliny pojawiły się następne antybiotyki: naturalne, półsyntetyczne i syntetyczne. Wprowadzenie antybiotyków do lecznictwa było przełomem dającym lekarzom oręż do walki z chorobami zakaźnymi, które do tej pory były przyczyną śmierci i chorób setek milionów osób.
Pod względem budowy chemicznej antybiotyki należą do różnych grup związków organicznych. Z tysięcy naturalnie występujących antybiotyków zaledwie kilkadziesiąt mogło być włączonych do leczenia ludzi i zwierząt. Pozostałe nie znajdują zastosowania w medycynie ze względu na toksyczność lub działania niepożądane.
Zastosowania medyczne
[edytuj | edytuj kod]Antybiotyki są stosowane w leczeniu lub zapobieganiu infekcjom bakteryjnym, a czasami infekcjom pierwotniakowym. (Metronidazol jest skuteczny przeciwko wielu chorobom pasożytniczym). Gdy podejrzewa się, że infekcja jest odpowiedzialna za chorobę, ale odpowiedzialny patogen nie został zidentyfikowany, podaje się antybiotyk o szerokim spektrum działania w oparciu o oznaki i objawy i jest rozpoczynane w oczekiwaniu na wyniki laboratoryjne, które mogą potrwać kilka dni[1][10].
Gdy odpowiedzialny mikroorganizm chorobotwórczy jest już znany, można rozpocząć terapię celowaną. Zazwyczaj wiąże się to z zastosowaniem antybiotyku o wąskim spektrum działania. Wybór podawanego antybiotyku może zmniejszyć koszty i toksyczność antybiotykoterapii, a także zmniejszyć możliwość pojawienia się oporności na środki przeciwdrobnoustrojowe[1][10]. Antybiotyki mogą być podawane w przypadku niepowikłanego ostrego zapalenia wyrostka robaczkowego w celu uniknięcia leczenia operacyjnego[11][12].
Antybiotyki mogą być podawane profilaktycznie jako środek zapobiegawczy i jest to zwykle ograniczone do populacji zagrożonych, takich jak osoby z osłabionym układem odpornościowym (szczególnie w przypadku HIV, aby zapobiec zapaleniu płuc), osoby przyjmujące leki immunosupresyjne, pacjenci z rakiem i osoby poddawane zabiegom chirurgicznym, oraz u pacjentów z implantami, np. sztuczna zastawka serca (także wszczepiana przezskórnie). Ich zastosowanie w procedurach chirurgicznych ma pomóc w zapobieganiu infekcji. Odgrywają one ważną rolę w profilaktyce antybiotykowej zębów podczas procedury stomatologicznej wymagającej ingerencji w obrębie dziąseł, gdzie ich stosowanie może zapobiegać zakażeniom bakteryjnym[1][2][4].
Formy podania antybiotyku
[edytuj | edytuj kod]Antybiotyki mogą być stosowane w postaci[2]:
- tabletek, kapsułek lub płynu do picia – można ich używać do leczenia większości łagodnych do umiarkowanych infekcji
- kremów, balsamów, sprayów i kropli – są często używane do leczenia infekcji skóry oraz infekcji oczu lub ucha
- zastrzyków – można je podawać w postaci injekcji domięśniowej lub dożylnej bezpośrednio do krwi i są stosowane w przypadku poważniejszych infekcji
Mechanizm działania
[edytuj | edytuj kod]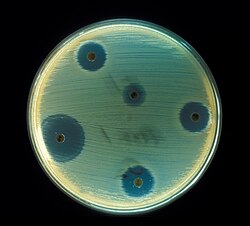
Działanie antybiotyków polega na powodowaniu śmierci komórki bakteryjnej (działanie bakteriobójcze) lub wpływaniu w taki sposób na jej metabolizm, aby ograniczyć jej możliwości rozmnażania się (działanie bakteriostatyczne), a bakterie niszczone są przez mechanizmy obronne chorego[1][2][13].
Leczenie chorób zakaźnych polega na zabiciu mikroorganizmów wywołujących chorobę. Trudność terapii, z którą borykali się lekarze przed erą antybiotyków polegała na tym, żeby znaleźć środek jednocześnie zabójczy dla chorobotwórczych bakterii i bezpieczny dla gospodarza.
Antybiotyki zazwyczaj zakłócają procesy metaboliczne mikroorganizmów. Penicylina działa poprzez uszkadzanie ściany komórkowej i ostatecznie niszczy bakterie. Podstawą terapii antybiotykami jest zasada selektywnej toksyczności Ehrlicha, zgodnie z którą antybiotykiem jest substancja, która w organizmie, w stężeniu niewykazującym większej toksyczności dla ludzi i zwierząt wyższych, powoduje uszkodzenie lub śmierć mikroorganizmów. Można to osiągnąć przez stosowanie substancji oddziałujących na takie struktury, które są obecne w komórkach mikroorganizmów, a których nie ma w organizmie człowieka lub występują w nim w innej formie[14].
Główne mechanizmy działania antybiotyków to[15]:
- zakłócanie syntezy ściany komórkowej bakterii, np. penicylina[16]
- upośledzenie przepuszczalności błony komórkowej bakterii umożliwiających transport jonów[17], np. gramicydyna
- zakłócanie syntezy kwasów nukleinowych:
- hamowanie biosyntezy folianów niezbędnych do syntezy DNA
- hamowanie na różnych etapach, np. trimetoprym[18]
- hamowanie działania topoizomeraz, np. cyprofloksacyna
- Zakłócanie syntezy białek, np. aminoglikozydy[19]
Osobnym problemem jest szkodliwość dla naturalnej flory bakteryjnej człowieka[1][20].
Podział
[edytuj | edytuj kod](podział ze względu na budowę chemiczną)
Antybiotyki
- β-laktamy[21]:
- penicyliny[14]:
- penicyliny naturalne – penicylina benzylowa
- penicyliny „przeciwgronkowcowe” – oksacylina, nafcylina, metycylina
- aminopenicyliny – ampicylina, amoksycylina
- karboksypenicyliny – tykarcylina
- ureidopenicyliny – azlocylina
- piperazylopenicyliny – piperacylina
- amidynopenicyliny – mecylinam
- temocylina
- cefalosporyny (podział stanowiący połączenie tradycyjnych podziałów na 4–5 generacji lub 4 grupy)[22]:
- cefalosporyny grupy 0 – cefradyna, cefprozyl
- cefalosporyny I generacji – cefazolina - stosowane doustnie w zakażeniach skóry i tkanki podskórnej spowodowanych przez paciorkowce i gronkowce. Profilaktycznie podawana parenteralnie przed zabiegami kardiochirurgicznymi i ginekologicznymi[23]
- cefalosporyny II generacji – cefuroksym, cefamandol, cefaklor
- cefalosporyny III generacji nieaktywne wobec Pseudomonas aeruginosa – cefotaksym, ceftriakson
- cefalosporyny III generacji aktywne wobec Pseudomonas aeruginosa – ceftazydym, cefoperazon
- cefalosporyny IV generacji – cefepim, ceftan
- cefalosporyny V generacji aktywne wobec Pseudomonas aeruginosa – ceftobiprol
- cefalosporyny V generacji nieaktywne wobec Pseudomonas aeruginosa – ceftarolina
- cefamycyny – cefoksytyna
- monobaktamy – aztreonam
- karbapenemy:
- trinemy – sanfetrinem
- penemy – faropenem
- inhibitory β-laktamaz – same w sobie przeważnie nie mają aktywności bakteriobójczej, stosuje się je w połączeniu z innymi antybiotykami np. cefoperazon z sulbaktamem, amoksycylina z kwasem klawulanowym, piperacylina z tazobaktamem
- penicyliny[14]:
- antybiotyki peptydowe
- polipeptydy:
- streptograminy – chinuprystyna-dalfoprystyna
- glikopeptydy:
- I generacji – wankomycyna, teikoplanina
- II generacji – orytawancyna
- lipopeptydy – daptomycyna
- glikolipopeptydy – dalbawancyna, telawancyna
- glikolipodepsypeptydy – ramoplanina
- aminoglikozydy:
- aminoglikozydy streptydynowe – streptomycyna
- aminoglikozydy deoksystreptaminowe – gentamycyna, amikacyna, tobramycyna, netylmycyna
- aminocyklitole – spektynomycyna
- tetracykliny[24]:
- tetracykliny właściwe – doksycyklina
- glicylocykliny – tygecyklina
- makrolidy:
- 14-węglowe – erytromycyna, klarytromycyna
- 15-węglowe – azytromycyna
- 16-węglowe – spiramycyna
- ketolidy – telitromycyna
- 18-węglowe (tiakumycyny) – difimycyna
- linkozamidy – klindamycyna, linkomycyna
- amfenikole – chloramfenikol
- ryfamycyny – ryfampicyna, ryfaksymina
- pleuromutyliny – retapamulina
- mupirocyna
- kwas fusydynowy
Leki przeciwprątkowe (leczenie zakażeń wywołanych przez prątki, np. gruźlicy lub trądu:
- leki 1. rzutu – izoniazyd, ryfampicyna, pirazynamid, etambutol, streptomycyna
- leki 2. rzutu – etionamid, klofazymina, kanamycyna, kapreomycyna, amikacyna, tobramycyna, wiomycyna, kwas p-aminosalicylowy, cykloseryna, ofloksacyna, cyprofloksacyna, lewofloksacyna, moksyfloksacyna, klarytromycyna, azytromycyna, imipenem, cefoksytyna, doksycyklina, minocyklina, kotrimoksazol, tioacetazon, linezolid, ryfabutyna, ryfapentyna
- leki do leczenia trądu – dapson, acedapson, talidomid (tylko mężczyźni); w leczeniu trądu stosuje się także ryfampicynę i klofazyminę
Leki przeciwgrzybicze:
- antybiotyki polienowe – amfoterycyna B, nystatyna, natamycyna
- antybiotyki niepolienowe – gryzeofulwina
- leki azolowe:
- leki imidazolowe – ketokonazol
- leki triazolowe:
- I generacji – flukonazol, itrakonazol
- II generacji – worykonazol, rawukonazol, posakonazol (lek o najszerszym spektrum działania)
- echinokandyny – kaspofungina, anidulafungina, mikafungina
- allyloaminy – terbinafina
- 5-fluorocytozyna
- amorolfina
- cyklopiroks
- tolnaftat
- jodek potasu
Antybiotyki można podzielić również według innych kryteriów, mających większe znaczenie ze względu na zastosowanie antybiotyków w terapii. Leki te różnią się między innymi:
- Wchłanianiem po podaniu doustnym. Antybiotyki wchłaniają się z jelit w różnym stopniu. Powoduje to konieczność podawania niektórych antybiotyków dożylnie lub domięśniowo.
- Antybiotyki dobrze wchłaniające się z przewodu pokarmowego: makrolidy, chloramfenikol, tetracykliny
- Antybiotyki słabo wchłaniające się z przewodu pokarmowego: ampicylina, gryzeofulwina, linkomycyna
- Antybiotyki niewchłaniające się z przewodu pokarmowego (konieczne jest podawanie pozajelitowe): cefalosporyny IV generacji, większość aminoglikozydów, polimyksyny, monobaktamy, karbapenemy
- Łatwością przenikania do tkanek. Niektóre antybiotyki po wchłonięciu do układu krążenia pozostają w łożysku naczyniowym i słabo przenikają do tkanek organizmu. Ogranicza to możliwość ich stosowania w niektórych zakażeniach – np. jeśli zakażeniu ulegną płuca, antybiotyk o niskiej zdolności penetrowania tkanek nie będzie skutecznie niszczył mikroorganizmów, gdyż jego stężenie w miejscu działania będzie zbyt małe. Czynnikami decydującymi o zdolności przenikania do tkanek są: lipofilowość cząsteczki antybiotyku, stopień wiązania z białkami krwi, pH w miejscu docelowym i wiele innych. Ze względu na łatwość przenikania do tkanek antybiotyki można podzielić na:
- dobrze przenikające: tetracykliny, chloramfenikol, makrolidy
- słabo lub średnio przenikające: polimyksyny, gentamycyna, streptomycyna
- Drogą wydalania. Większość antybiotyków jest wydalana przez nerki z moczem. Tylko niektóre są wydalane z żółcią. Ma to znaczenie terapeutyczne, gdyż dobierając antybiotyk trzeba uwzględnić współistniejące choroby pacjenta, takie jak niewydolność nerek – w takim przypadku antybiotyki eliminowane drogą nerkową mogą się kumulować w organizmie i powodować dodatkowe działania niepożądane.
- Antybiotyki wydalane z moczem: gentamycyna, wankomycyna, wiomycyna, chloramfenikol
- Antybiotyki wydalane z żółcią: ryfampicyna, makrolidy
Działania niepożądane
[edytuj | edytuj kod]Antybiotyki są lekami względnie mało toksycznymi, ich właściwości toksyczne są znacznie większe w stosunku do mikroorganizmu niż do organizmu gospodarza. Niemniej, niektóre antybiotyki mogą wywoływać działania niepożądane[1][2][12].
Wyróżnia się trzy główne grupy niepożądanych działań antybiotyków:
- Bezpośrednie działanie toksyczne jest charakterystyczne dla danej grupy antybiotyków lub konkretnego leku. Do najważniejszych działań toksycznych należą:
- działanie nefrotoksyczne (na nerki) – wywołują je między innymi polimyksyny, aminoglikozydy[25]
- działanie hepatotoksyczne (na wątrobę) – wywołują je między innymi tetracykliny[26], nowobiocyna[27]
- działanie ototoksyczne (niszczą struktury ucha wewnętrznego) – wywołują je między innymi aminoglikozydy[25]
- działanie toksyczne na szpik kostny – wywołuje je między innymi chloramfenikol[28]
- Reakcje uczuleniowe. Wiele antybiotyków wywołuje reakcje uczuleniowe. Ich siła i natężenie mogą być różne, od wysypek skórnych, przez obrzęki, duszność i gorączkę aż do wstrząsu anafilaktycznego (uczuleniowego) mogącego prowadzić nawet do śmierci. Najbardziej niebezpieczne są pod tym względem powszechnie stosowane penicyliny, dlatego przed ich podaniem powinno się wykonać test uczuleniowy[14][29].
- Dysbakteriozy i ich następstwa. Działaniem niepożądanym antybiotyków, zwłaszcza podawanych doustnie, jest możliwość zmniejszenia lub znacznego wytrzebienia naturalnej flory bakteryjnej człowieka. Konsekwencjami tego zjawiska mogą być zaburzenia trawienia i przyswajania składników odżywczych z nudnościami i/lub biegunką i następujące po tym niedobory (głównie witamin) oraz możliwość nadkażeń. Do nadkażeń może dochodzić w wyniku zajęcia przez obce, szkodliwe mikroorganizmy miejsca, w którym zazwyczaj żyją bakterie stanowiące naturalną, korzystną florę bakteryjną. Najczęściej są to zakażenia opornymi na antybiotyki gronkowcami lub pałeczkami lub zakażenia grzybicze. Tego typu nadkażenia mogą być bardzo niebezpieczne i prowadzić nawet do śmierci pacjenta[1][2][20][29].
Interakcje antybiotyków
[edytuj | edytuj kod]Antybiotyki mogą czasami wchodzić w interakcje z innymi lekami lub substancjami. Oznacza to, że mogą mieć działanie inne niż oczekiwane[2]:
- podczas kuracji Metronidazolem unikać alkoholu nadal przez 48 godzin po zaprzestaniu przyjmowania metronidazolu lub tinidazolem unikać alkoholu nadal przez 72 godzin po zaprzestaniu przyjmowania tinidazolu (picie alkoholu z metronidazolem lub tinidazolem może powodować bardzo nieprzyjemne skutki uboczne, takie jak: ból brzucha, uderzenia gorąca, szybkie lub nieregularne bicie serca, ból głowy, zawroty głowy,senność
- ryfampicyna i ryfabutyna mogą zmniejszać skuteczność tabletki antykoncepcyjnej
- tetracykliny podawane razem z produktami nabiałowymi tracą swoją aktywność biologiczną, gdyż leki te chętnie łączą się z jonami wapnia, glinu, żelaza (chelatowanie)[24]
Oporność na antybiotyki
[edytuj | edytuj kod]Oporność na antybiotyki nie jest chorobą, ale cechą pewnych szczepów bakteryjnych, która umożliwia im przetrwanie w obecności antybiotyku. W zależności od pochodzenia, dzieli się ją na pierwotną (naturalna struktura bakterii uniemożliwiająca działanie leku) lub nabytą – na skutek nabycia genów oporności od innych bakterii lub spontanicznych mutacji[30]. Oporność na środki przeciwdrobnoustrojowe jest w dużej mierze spowodowana niewłaściwym i nadmiernym stosowaniem środków przeciwdrobnoustrojowych[1][14][19][31][32].
Pojawienie się bakterii opornych na antybiotyki jest powszechnym zjawiskiem spowodowanym głównie nadużywaniem/niewłaściwym stosowaniem. Stanowi to zagrożenie dla zdrowia na całym świecie. Zakażenia wywołane przez bakterie oporne na antybiotyki mogą wymagać większej ostrożności, a także alternatywnych i droższych antybiotyków, które mogą również mieć poważniejsze skutki uboczne. Leczenie bakterii opornych na antybiotyki może również wymagać dożylnych antybiotyków podawanych w szpitalach zamiast doustnych antybiotyków, które pacjenci mogliby przyjmować w domu[32][33][34]. Każdego roku prawie 5 milionów zgonów jest związanych z opornością na antybiotyki na całym świecie[31].
Częsta oporność wśród bakterii wiąże się z nieracjonalną antybiotykoterapią oraz zbyt dużym zużyciem tych leków w przemyśle spożywczym. W wielu krajach (np. USA) i w UE spowodowana jest stosowaniem środków przeciwdrobnoustrojowych u zwierząt służących do produkcji żywności. Dawki te są zbyt małe, aby zabić wszystkie bakterie, świetnie więc stymulują wyrobienie przez bakterie antybiotykooporności[32][35].
Antybiotyki takie jak penicylina i erytromycyna, które wcześniej miały wysoką skuteczność przeciwko wielu gatunkom i szczepom bakterii, stały się mniej skuteczne ze względu na zwiększoną oporność wielu szczepów bakterii[36].
Oporność może przybrać formę biodegradacji farmaceutyków, takich jak bakterie glebowe rozkładające sulfametazynę[37]. Przetrwanie bakterii często wynika z dziedzicznej oporności[38], ale wzrost oporności na środki przeciwbakteryjne następuje również poprzez horyzontalny transfer genów. Transfer horyzontalny jest bardziej prawdopodobny podczas częstego stosowania antybiotyków[39][40].
Zdolności genetyczne drobnoustrojów skorzystały z nadużywania antybiotyków przez człowieka w celu wykorzystania każdego źródła genów oporności i każdego środka poziomej transmisji genów w celu opracowania wielu mechanizmów oporności na każdy antybiotyk wprowadzony do praktyki klinicznej, rolniczej lub innej[6].
Przykłady powszechnych bakterii opornych na wiele leków to[32]:
- Metycylinooporny Gronkowiec złocisty (MRSA)
- Enterokoki oporne na wankomycynę lub Teikoplaninę (VRE)
- Enterobakterie wytwarzające beta-laktamazy o rozszerzonym spektrum działania (ESBL) (przykładami powszechnych Enterobacteriaceae są pałeczka okrężnicy i pałeczka zapalenia płuc
- Pałeczka ropy błękitnej oporna na wiele leków
Dwa główne obszary kontroli i zapobiegania oporności na środki przeciwdrobnoustrojowe to[32]:
- rozważne stosowanie środków przeciwdrobnoustrojowych (tj. tylko wtedy, gdy jest to konieczne, w odpowiedniej dawce, w odpowiednich odstępach czasu i przez odpowiedni czas trwania);
- środki ostrożności higieniczne w celu kontroli krzyżowej transmisji drobnoustrojów opornych na środki przeciwdrobnoustrojowe (kontrola zakażeń), w tym higiena rąk, badania przesiewowe, izolacja itp.
Wytwarzanie antybiotyków
[edytuj | edytuj kod]Naturalne antybiotyki są produkowane przez niektóre gatunki grzybów, szczególnie pleśni Penicillium, oraz przez niektóre bakterie, np. z rzędu promieniowców. Na podstawie dotychczasowych badań ustalono, że 80% poznanych antybiotyków pochodzenia naturalnego to metabolity promieniowców[9]. Syntetyzowane w ich organizmach antybiotyki nie są szkodliwe dla nich samych dzięki licznym mechanizmom obronnym[41].
Zdolność do wytwarzania antybiotyków jest ewolucyjnym przystosowaniem organizmów do życia w środowisku naturalnym. Daje posiadającym ją mikroorganizmom przewagę nad innymi, utrudniając wrażliwym szczepom wzrost i tym samym uniemożliwia im konkurowanie w walce o dostęp do pożywienia.
Produkcja przemysłowa
[edytuj | edytuj kod]Wraz z postępem w dziedzinie chemii medycznej przemysł medyczny koncentruje się na wytwarzaniu antybiotyków półsyntetycznych[42]:
- skuteczniejszych – silniejszych w działaniu i wykazujących szerszy zakres działania
- trwalszych chemicznie
- odporniejszych na β-laktamazy
- tańszych w produkcji
Niektóre antybiotyki uzyskuje się na skalę przemysłową metodami syntezy chemicznej. Wiele z nich jest produkowanych metodami biotechnologicznymi w wielkich fermentorach (bioreaktorach) o pojemności ok. 50 do 300 m³. W bioreaktorach przeprowadza się reakcje biosyntezy antybiotyków naturalnych przez odpowiednie mikroorganizmy oraz reakcje biotransformacji. Biotransformacja (w syntezie antybiotyków) polega na przekształceniu jednych związków chemicznych (substratów) w inne (produkty) za pomocą enzymów formie czystej, mikroorganizmów lub komórek organizmów wyższych.
Produkt, jaki można otrzymać z danego substratu, zależy od wielu czynników. Najważniejsze z nich to:
- rasa mikroorganizmu
- pH
- stężenie substratu
- użyte do hodowli składniki odżywcze i inne warunki hodowli
- użyte dodatkowe substancje, np. inhibitory enzymów
Zobacz też
[edytuj | edytuj kod]Przypisy
[edytuj | edytuj kod]- ↑ a b c d e f g h i NAJCZĘŚCIEJ ZADAWANE PYTANIA NA TEMAT ANTYBIOTYKÓW. antybiotyki.edu.pl. [dostęp 2025-05-09]. (pol.).
- ↑ a b c d e f g Antibiotics. www.nhs.uk. [dostęp 2025-05-23]. (ang.).
- ↑ Factsheet for experts. web.archive.org. [dostęp 2025-05-06]. (ang.).
- ↑ a b Pod redakcją: dr n. med. Agnieszki Żukowskiej, prof. dr hab. n. med. Walerii Hryniewicz - Rekomendacje diagnostyki, terapii i profilaktyki antybiotykowej zakażeń w szpitalu – 2020; s:168-182, ISBN 978-83-949636-3-7. antybiotyki.edu.pl. [dostęp 2025-05-07]. (pol.).
- ↑ SELMAN A. WAKSMAN: WHAT IS AN ANTIBIOTIC OR AN ANTI- BIOTIC SUBSTANCE?| https://www.tandfonline.com/doi/abs/10.1080/00275514.1947.12017635, access date 2025.05.25, language: English
- ↑ a b Julian Davies, Dorothy Davies: Origins and Evolution of Antibiotic Resistance. Microbiol Mol Biol Rev. 2010 Sep;74(3):417–433| https://pmc.ncbi.nlm.nih.gov/articles/PMC2937522/, access date 2025.05.25, language: English
- ↑ Sir Alexander Fleming – Biographical, [w:] NobelPrize.org [online] [dostęp 2017-10-11] (ang.).
- ↑ Marek Chmielewski, Historia odkrycia penicyliny, [w:] Portal Wiedzy [online], Polska Akademia Nauk, 14 stycznia 2009 [dostęp 2017-10-11].
- ↑ a b Narendra Kumar, Ravi Kant Singh, Mishra S.K., Singh A.K., Pachouri U.C.: Isolation and screening of soil Actinomycetes as source of antibiotics active against bacteria. Int. J. Microbiol. Res. 2, 12–16 (2010) | https://bioinfopublication.org/files/articles/2_2_3_IJMR.pdf, access date 2025.05.06, language: English
- ↑ a b Leekha S, Terrell CL, Edson RS. General principles of antimicrobial therapy. Mayo Clinic Proceedings. 2011, 86 (2): 156–167 | https://www.mayoclinicproceedings.org/article/S0025-6196(11)60140-7/fulltext, access date 2025.05.06, language: English
- ↑ Rollins KE, Varadhan KK, Neal KR, Lobo DN (October 2016). "Antibiotics Versus Appendicectomy for the Treatment of Uncomplicated Acute Appendicitis: An Updated Meta-Analysis of Randomised Controlled Trials". World Journal of Surgery. 40 (10): 2305–2318 | https://onlinelibrary.wiley.com/doi/10.1007/s00268-016-3561-7, access date 2025.05.06, language: English
- ↑ a b Thomas G. Slama, Alpesh Amin, MBA, Stephen A. Brunton: A clinician’s guide to the appropriate and accurate use of antibiotics: the Council for Appropriate and Rational Antibiotic Therapy (CARAT) criteria. Am J Medicine, (2005) 118 (7A), 1S–6S | https://www.amjmed.com/action/showPdf?pii=S0002-9343%2805%2900381-5, access date 2025.05.09, language: English
- ↑ Beers i inni 2006 ↓, s. 1831.
- ↑ a b c d Penicillin. my.clevelandclinic.org. [dostęp 2025-05-09]. (ang.).
- ↑ Beers i inni 2006 ↓, s. 1830.
- ↑ Beers i inni 2006 ↓, s. 1851.
- ↑ B. C. PRESSMAN, E. J. HARRIS,t W. S. JAGGER, AND J. H. JOHNSON: ANTIBIOTIC-MEDIATED TRANSPORT OF ALKALI IONS ACROSS LIPID BARRIERS* | https://www.pnas.org/doi/pdf/10.1073/pnas.58.5.1949, access date 2025.05.23, language: English
- ↑ Beers i inni 2006 ↓, s. 1863.
- ↑ a b Beers i inni 2006 ↓, s. 1846.
- ↑ a b Antibiotic - Associated Diarrhea - All You Should Know. web.archive.org. [dostęp 2025-05-09]. (ang.).
- ↑ Beers i inni 2006 ↓, s. 1849-.
- ↑ Beers i inni 2006 ↓, s. 1850-1851.
- ↑ Beers i inni 2006 ↓, s. 1850.
- ↑ a b Beers i inni 2006 ↓, s. 1864-1865.
- ↑ a b Beers i inni 2006 ↓, s. 1846-1849.
- ↑ Beers i inni 2006 ↓, s. 1864.
- ↑ T J Walsh, H C Standiford, A C Reboli at all.: Randomized double-blinded trial of rifampin with either novobiocin or trimethoprim-sulfamethoxazole against methicillin-resistant Staphylococcus aureus colonization: prevention of antimicrobial resistance and effect of host factors on outcome., access date 2025.05.23, language: English
- ↑ Beers i inni 2006 ↓, s. 1854.
- ↑ a b Side effects - Antibiotics. www.nhs.uk. [dostęp 2025-05-09]. (ang.).
- ↑ Beers i inni 2006 ↓, s. 1832.
- ↑ a b Better use of vaccines could reduce antibiotic use by 2.5 billion doses annually, says WHO. www.who.int. [dostęp 2025-05-06]. (ang.).
- ↑ a b c d e Factsheet for experts. web.archive.org. [dostęp 2025-05-23]. (ang.).
- ↑ Calls to rein in antibiotic use after study shows 65% increase worldwide. www.theguardian.com. [dostęp 2025-05-06]. (ang.).
- ↑ Singh G, Rana A, Smriti : Decoding antimicrobial resistance: unraveling molecular mechanisms and targeted strategies. Archives of Microbiology. 2024, 206 (6): 280 | https://link.springer.com/article/10.1007/s00203-024-03998-2, access date 2025.05.06, language: English
- ↑ Nie tylko świński problem, „Świat Nauki”, nr 5 (237), maj 2011, s. 22, ISSN 0867-6380.
- ↑ Antibiotic Resistance Fast-Growing Problem Worldwide. www.voanews.com. [dostęp 2025-05-06]. (ang.).
- ↑ Topp E, Chapman R, Devers-Lamrani M et al.: Accelerated Biodegradation of Veterinary Antibiotics in Agricultural Soil following Long-Term Exposure, and Isolation of a Sulfamethazine-degrading sp. Journal of Environmental Quality. 2013, 42 (1): 173–178. | https://acsess.onlinelibrary.wiley.com/doi/abs/10.2134/jeq2012.0162, access date 2025.05.06, language: English
- ↑ Witte W (2004). International dissemination of antibiotic resistant strains of bacterial pathogens. Infection, Genetics and Evolution. 4 (3): 187–91 | https://ui.adsabs.harvard.edu/abs/2004InfGE...4..187W/abstract, access date 2025.05.06, language: English
- ↑ M. Syvanen. Cross-species gene transfer; implications for a new theory of evolution. J Theor Biol. 1985, 112 (2), s. 333–343 | https://www.sciencedirect.com/science/article/abs/pii/S0022519385802915?via%3Dihub, access date 2025.05.06, language: English
- ↑ Michael Syvanen. Cross-species gene transfer: a major factor in evolution?. | http://www.dcn.davis.ca.us/vme/hgt/TrendsInGeneticspp1-4yr1986.PDF, access date 2025.05.06, language: English
- ↑ Helga U. van der Heul, Bohdan L. Bilyk, Kenneth J. McDowall, Ryan F. Seipke and Gilles P. van Wezel : Regulation of antibiotic production in Actinobacteria: new perspectives from the post-genomic era. Natural Product Reports, 2010, Vol. 35, No. 6, pp. 575-604 | https://eprints.whiterose.ac.uk/id/eprint/130173/1/NaturalProductsReports_April.pdf, access date 2025.05.06, language: English
- ↑ Franz von Nussbaum, Michael Brands, Berthold Hinzen , Stefan Weigand, Dieter Häbich: Antibacterial Natural Products in Medicinal Chemistry—Exodus or Revival?. Angewandte Chemie. 45 (31): 5072–129 | https://onlinelibrary.wiley.com/doi/10.1002/anie.200600350, access date 2025.05.06, language: English
Bibliografia
[edytuj | edytuj kod]- Mark H. Beers i inni, The Merck - podręcznik diagnostyki i terapii, wyd. III polskie, Wrocław: Elsevier Urban & Partner, 2006, ISBN 978-83-60290-99-6.
Linki zewnętrzne
[edytuj | edytuj kod]- Narodowy Program Ochrony Antybiotyków – strategia walki z antybiotykoopornością w Polsce
- European Surveillance of Antimicrobial Consumption (ESAC) – project on antibiotic consumption in Europe [online] [zarchiwizowane z adresu 2007-07-18].









